Ísótòpù
Àwọn ísótòpù tabi áísótòpù ni àwọn àyàsórísirísi ẹ́límẹ̀ntì kẹ́míkà pàtó kan. Bótilẹ̀jẹ́pé gbogbo àwọn ísótòpù ẹ́límẹ̀ntì kan ní iye prótọ̀nù kannáà, ísótòpù kọ̀ọ̀kan yàtọ̀ sí àwọn yìókù ní iye neutrons tó ní. Orúkọ ìsótòpù jẹ́ dídá láti èdè Gríìkì isos (ἴσος "dọ́gba") àti topos (τόπος "ibi"). Nítoríẹ̀: "ibi kannáà," túmọ̀sí pé àwọn Ísótòpù orísirísi ẹ́límẹ̀ntì kan wà ní orí àyè kannáà lórí tábìlì ìdásìkò àwọn ẹ́límẹ̀ntì. Iye àwọn prótọ̀nù nínú núkléù átọ̀mù ni óún ṣèyàtọ̀ àwọn ẹ́límẹ̀ntì sí ra wọn, sùgbọ́n ẹ́límẹ̀ntì kan le ní iye neutron èyíkéyìí. Iye àwọn núkléónì (protons ati neutrons) nínú núkléù ni nọ́mbà àkọ́jọ, and each isotope of a given element has a different mass number.
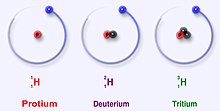
For example, carbon-12, carbon-13 and carbon-14 are three isotopes of the element carbon with mass numbers 12, 13 and 14 respectively. The atomic number of carbon is 6 which means that every carbon atom has 6 protons, so that the neutron numbers of these isotopes are 6, 7 and 8 respectively.

|
Àyọkà yìí tàbí apá rẹ̀ únfẹ́ àtúnṣe sí. Ẹ le fẹ̀ jù báyìí lọ tàbí kí ẹ ṣàtúnṣe rẹ̀ lọ́nà tí yíò mu kúnrẹ́rẹ́. Ẹ ran Wikipedia lọ́wọ́ láti fẹ̀ẹ́ jù báyìí lọ. |